
血小板是一种哺乳动物特有血细胞,没有细胞核,其表面表达大量膜受体,胞内具有线粒体,α-颗粒和致密颗粒,溶酶体等亚细胞结构。血小板主要发挥止血功能,并且在伤口愈合、血管稳态维持、血栓形成、肿瘤转移、器官移植排斥和机体防御等生理病理过程中发挥重要作用。血小板是由造血干细胞定向分化为巨核细胞祖细胞并通过增殖,成熟和终末分化等过程形成。血小板生成素(Thrombopoietin, TPO)是巨核细胞谱系的主要生长因子,它通过与其受体c-Mpl结合激活胞内Jak/Stat信号通路来诱导特定的基因转录驱动巨核祖细胞的增殖和成熟。一个健康人每天约可产生1200亿个血小板,巨核细胞持续分化是维持体内血小板水平的主要机制。巨核细胞发育和血小板生成异常会导致血小板减少症或血小板增多症的发生,造成出血性或血栓性疾病的发生,危害严重。目前对于血小板减少症和血小板增多症等疾病的治疗多是针对TPO/Mpl/Jak/Stat通路展开的,围绕该通路新调控机制开展研究,将有助于研发更为有效的血小板相关疾病治疗手段。
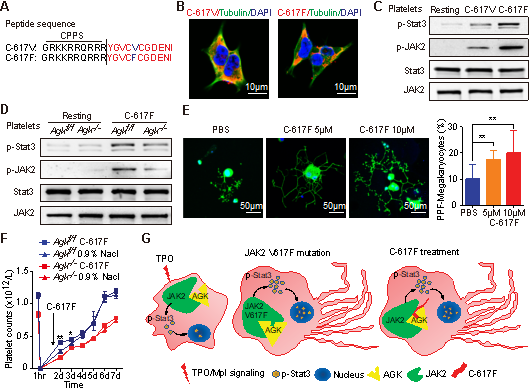
2020年3月23日,上海交通大学医学院刘俊岭课题组,在Blood上发表了The role of AGK in thrombocytopoiesis and possible therapeutic strategies的文章。酰基甘油激酶(AGK)是一种线粒体内膜激酶,能够催化磷脂酸和溶血磷脂酸的形成,作为线粒体TIM22蛋白转位复合物参与维持线粒体稳态,AGK突变被认为是Sengers综合征的主要病因,但其是否调控巨核细胞分化和血小板产生尚不清楚。在该研究中作者构建了巨核细胞/血小板特异的AGK缺失小鼠,发现该小鼠出现明显的血小板减少和脾肿大表型,进一步分析发现这主要是由于骨髓产生血小板减少和髓外造血过度所致。G126E突变能够抑制AGK的激酶活性,作者进一步构建了AGK G126E基因突变小鼠,发现AGK G126E突变不影响巨核细胞分化和外周血小板计数,这提示AGK参与巨核细胞发育和血小板生成并不依赖于其激酶活性。AGK缺失或AGK G126E突变都不影响血小板耗氧率(OCR),提示AGK可能并不是通过其线粒体功能影响血小板生成。作者进一步利用免疫沉淀方法鉴定出AGK可以与巨核细胞/血小板中的JAK2结合。更有趣的是,作者发现JAK2 V617F突变显著增强了AGK与JAK2的结合,并大大增强TPO引起的巨核细胞/血小板JAK2/Stat3信号激活和Stat3入核。作者进一步合成了JAK2-JH2结构域多肽YGVCF617CGDENI,发现其明显促进AGK与JAK2的结合,并且含有穿膜序列的YGVCF617CGDENI多肽大大促进了从胎肝造血干细胞诱导的前血小板的形成。
该项研究首次揭示了AGK在巨核细胞分化和血小板生成中的重要作用,并提示靶向AGK与JAK2的相互作用既可以用于治疗血小板减少症,也可以用于血小板增多症的治疗。目前该研究团队正在解析AGK与JAK2-JH2结构域相互作用的结构特征,并在筛选能够促进和干预两者结合的小分子化合物,期望发现用于临床治疗血小板减少症和血小板增多症的有效药物。
上海交通大学医学院刘俊岭课题组的博士研究生姜豪杰为本文的第一作者。该团队的博士后徐艳艳为共同通讯作者。天津实验血液学国家重点实验室的张磊教授和上海交通大学医学院郑俊克研究员和于卓副研究员提供了巨大帮助。该研究得到了国家杰出青年科学基金,国家自然科学基金重点项目,重大研究计划集成项目,国家自然科学基金青年项目等多项资金的大力资助。
原文链接:https://ashpublications.org/blood/article/doi/10.1182/blood.2019003851/452750/The-role-of-AGK-in-thrombocytopoiesis-and-possible